Farmacología
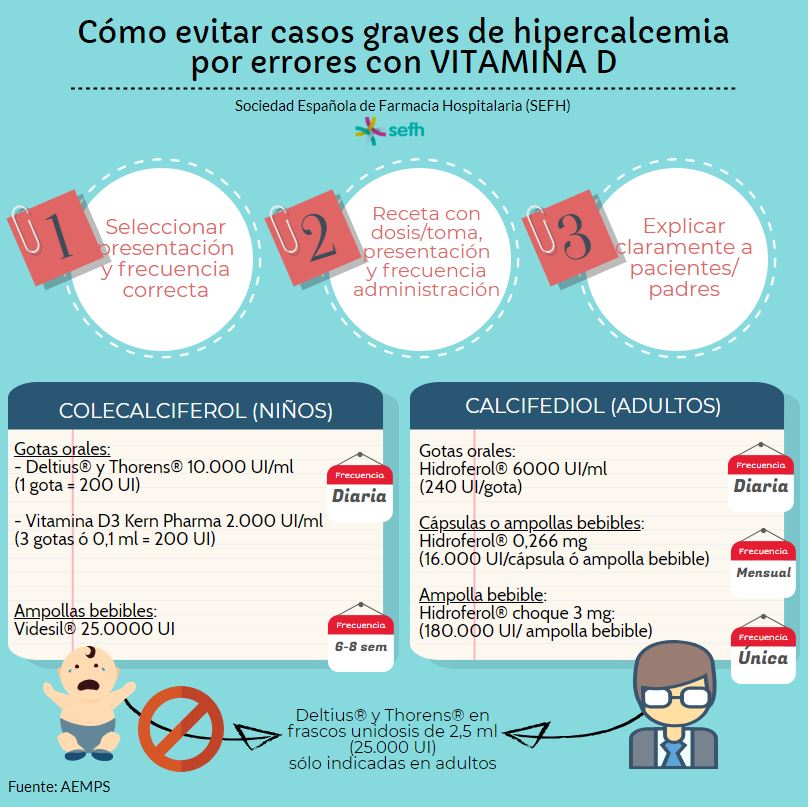
Vitamina D: casos graves de hipercalcemia por sobredosificación en pacientes adultos y en pediatría
22 marzo 2019
AEMPS, 19 de marzo de 2019

FDA retiro de lotes de losartán por tercer tipo de impureza de nitrosamina detectada en los medicamentos ARAII .
06 marzo 2019
FDA: información actualizada sobre productos farmacéuticos ARA II. Una nueva impureza de nitrosamina en ciertos lotes de losartán y el retiro del producto FDA, 1 de marzo 2019 primer retiro de ARAII resultante de la presencia de N-nitroso-N-metil-4-aminobutírico NMBA, que es el tercer tipo de impureza de nitrosamina detectada en los medicamentos ARAII .

Alertas de seguridad: tacrolimus
01 marzo 2019
Tacrolimus: microangiopatía trombótica; neuritis óptica; interacciones. emc, 25 de febrero de 2019

Alertas de seguridad: sunitinib
26 febrero 2019
Sunitinib: aneurisma y disección de la aorta; colitis. emc, 22 de febrero de 2019

Febuxostat (Uloric): FDA agrega una advertencia de recuadro para alertar del aumentao del riesgo de muerte con este medicamento para la gota
22 febrero 2019
