Farmacología

Uso de raza, etnia y origen geográfico como indicadores de grupos de ascendencia genética en publicaciones biomédicas
13 marzo 2024
Nuevas recomendaciones proponen no utilizar conceptos como raza, etnia y origen geográfico como indicadores sustitutos de ascendencia genética, basándose en la evidencia de que la variación genética en los individuos cae en un continuo de variación que no resulta bien captado por los descriptores de población existentes y que continuar usándolos como variables analíticas pone en peligro la validez científica de la investigación. Además, señalan que las prácticas científicas actuales a veces pueden perpetuar el pensamiento tipológico dañino sobre los individuos, incluido el racismo. JAMA, 12 de marzo de 2024.

Directrices para los protocolos de ensayos clínicos de intervenciones con inteligencia artificial: la extensión SPIRIT-AI
06 febrero 2024
SPIRIT-AI recomienda que los investigadores proporcionen descripciones claras de la intervención de IA, incluyendo las instrucciones y las habilidades necesarias para su uso, el entorno en el que se integrará la intervención de IA, las consideraciones para el manejo de los datos de entrada y salida, la interacción entre el ser humano y la IA y el análisis de los casos de error. SPIRIT-AI ayudará a promover la transparencia y la exhaustividad de los protocolos de los ensayos clínicos de las intervenciones de IA. Su uso ayudará a los editores y revisores, así como a los lectores en general, a comprender, interpretar y valorar críticamente el diseño y el riesgo de sesgo de un futuro ensayo clínico. Rev Panam Salud Publica. 26 de enero de 2024

Uso de la inteligencia artificial generativa en publicaciones académicas y científicas: todavía no hay reglas uniformes
31 enero 2024
No todas las principales editoriales y revistas médicas tienen guías sobre el uso de la inteligencia artificial generativa (IAG) por parte de los autores y, en las que existen, los usos permitidos de la IAG y cómo debería divulgarse varían sustancialmente. La falta de estandarización supone una carga para los autores y podría limitar la eficacia de las regulaciones. British Medical Journal, 31 de enero de 2024.

Todas las investigaciones que involucran seres humanos requieren aprobación ética
17 enero 2024
Un editorial reciente de los Archivos Argentinos de Pediatría nos recuerda que los comités de ética en investigación (CEI) son los organismos en los que la sociedad descansa la responsabilidad de velar por los intereses de los participantes en investigaciones. Llama la atención que se siga discutiendo sobre la necesidad o no de someter a la evaluación de un CEI un proyecto de investigación antes de llevarlo a cabo. Archivos Argentinos de Pediatría, diciembre de 2023.
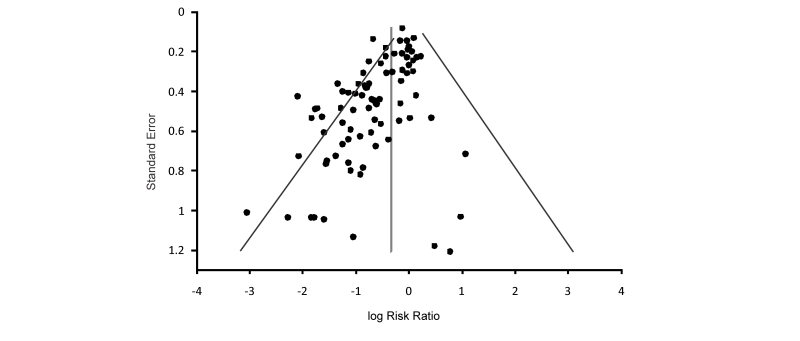
Pensamientos positivos sobre estudios negativos: el sesgo de publicación
10 enero 2024
