Farmacología
Ensayo “Solidarity” de tratamiento para COVID-19: Actualización sobre hidroxicloroquina
19 junio 2020
OMS, 17 de junio de 2020Los investigadores no aleatorizarán más pacientes a hidroxicloroquina en el ensayo Solidarity. Los pacientes que ya han comenzado la hidroxicloroquina pero que aún no han terminado su curso en el ensayo pueden completar su curso o detenerse a discreción del médico supervisor.Esta decisión se aplica solo a la realización del ensayo Solidarity y no se aplica al uso o evaluación de hidroxicloroquina en la profilaxis previa o posterior a la exposición en pacientes expuestos a COVID-19.
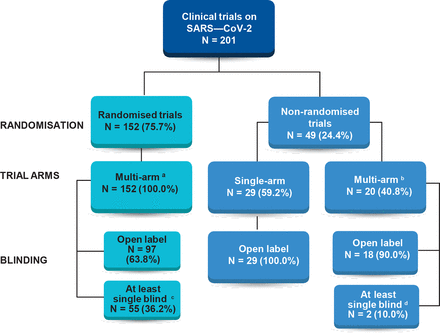
Características de los ensayos clínicos registrados que evalúan los tratamientos para COVID-19: un análisis transversal
12 junio 2020
Si bien la aceleración de la morbilidad y la mortalidad por la pandemia de COVID-19 ha sido paralela a la investigación clínica temprana y rápida, muchos ensayos carecen de características para optimizar su valor científico. La coordinación global y el aumento de la financiación de la investigación de alta calidad pueden ayudar a maximizar el progreso científico en el descubrimiento rápido de tratamientos seguros y efectivos. BMJ Open 2020

Hidroxicloroquina en COVID-19: Una prueba ácida a la investigación biomédica. DIME
09 junio 2020
DIME (decisiones informadas sobre medicamentos). Boletín #11 , 8 de junio de 2020. El boletín presenta una cronología de los acontecimientos y de los hallazgos detrás de la investigación clínica de HCQ en COVID-19. La construcción de un modelo independiente y confiable, fundado en principios éticos y científicos sólidos, es el principal reto actual para la comunidad científica global. Posiblemente ningún modelo esté libre de fallas y conflictos, pero hay lecciones a considerar

Características de aprobación regulatoria de productos antimicrobianos versus no antimicrobianos, 1984–2018: una evaluación de las flexibilidades de la Administración de Alimentos y Medicamentos
05 junio 2020
Excepto por el estado de la Ley de Medicamentos Huérfanos, se han utilizado pruebas clínicas aceleradas y programas de revisión al menos tan frecuentemente para productos antimicrobianos como para medicamentos no antimicrobianos. Ninguna evidencia respalda las afirmaciones de que el progreso de los antimicrobianos a través del proceso de aprobación regulatoria en los EE. UU. Es más lento que el desarrollo no antimicrobiano. Lancet Infect Dis 2 de junio de 2020

Seguridad de los medicamentos en pacientes geriátricos: estado actual y propuesta del camino a seguir
04 junio 2020
