Farmacología

Evaluación de la supervivencia libre de progresión como variable subrogada de la supervivencia general en el tratamiento de primera línea contra el cáncer de ovario
14 enero 2020
JAMA Netw Open. 2020 la supervivencia general es el punto final preferido en los ensayos de tratamiento de primera línea o tratamiento de mantenimiento, y que la supervivencia libre de progresión debe estar respaldada por puntos finales adicionales si se usa como desenlace principal.

¿La evidencia del mundo real (RWE) se traduce en evidencia creíble?
08 enero 2020
Clinical Pharmacology & Therapeutics. diciembre de 2019 Con el fin de garantizar que los nuevos métodos analíticos sean aceptables para los reguladores, los autores de un nuevo artículo publicado en Clinical Pharmacology & Therapeutics dicen que la RWE requerirá pruebas y validación de casi la misma manera que se evalúa un nuevo medicamento: "prospectivamente, bien controlado y de acuerdo con el plan acordado previamente". Los autores (que representan a los funcionarios de la EMA) afirman que la "clave última para lograr la credibilidad es comenzar con una mentalidad abierta pero 'agnóstica' y someter métodos novedosos a un ejercicio de validación justo, transparente y prospectivo; esto no se puede hacer sólo por corridas secas con productos antiguos"

Diferencias de género en el modo de informar los resultados de las investigaciones
27 diciembre 2019
Los varones tienden a utilizar más palabras positivas en la presentación de sus estudios, y a ser más citados posteriormente. British Medical Journal, diciembre de 2019

Las encuestas online y la falsa ilusión de la n grande. A propósito de una encuesta sobre la eutanasia en profesionales médicos
20 diciembre 2019
El uso de estudios basados en encuestas online se ha extendido de manera notable. A pesar de tener tasas de respuesta especialmente pequeñas, permiten obtener con facilidad un gran tamaño de muestra. Sin embargo, esta estrategia puede conllevar un sesgo de selección que comprometa notablemente los resultados. Gac Sanit.2019
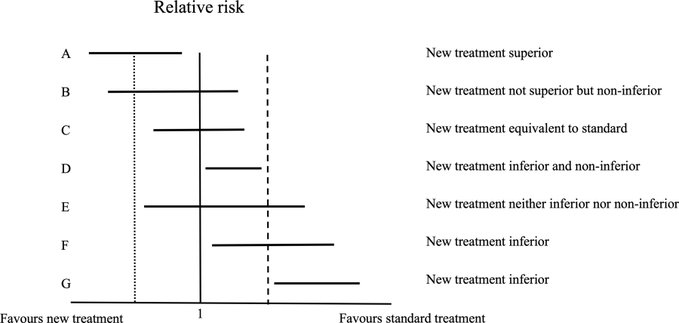
Ensayos de no inferioridad en cardiología: lo que los médicos deben saber
18 diciembre 2019
