Farmacología

Reducción del precio de los medicamentos con el uso de precios de referencia internacionales
09 noviembre 2021
Este estudio analiza el ahorro posible para Estados Unidos si utilizara el mecanismo de precios de referencia internacionales para fijar un tope al precio de las adquisiciones de fármacos por parte del Gobierno y de la seguridad social. Este enfoque debería explorarse también para el análisis de los precios de los medicamentos en Argentina. JAMA, septiembre de 2021.
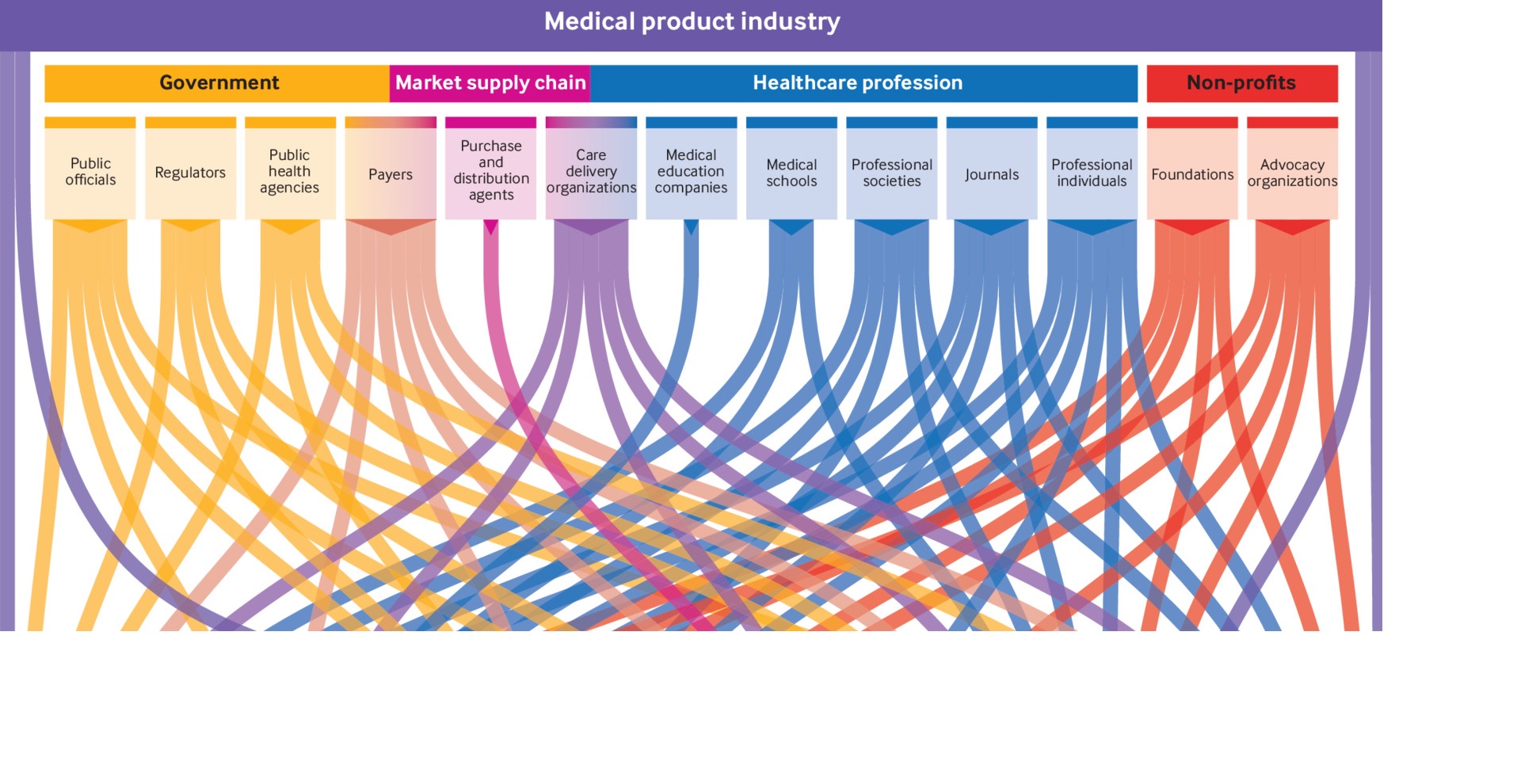
Un mapa de los vínculos entre la industria de productos médicos y el ecosistema sanitario
04 noviembre 2021
Esta revisión muestra que existe una extensa red de vínculos de la industria de productos médicos con actividades y actores del ecosistema de la salud, pero faltan políticas para los conflictos de intereses y hay pocos datos disponibles públicamente. Se necesita una mayor supervisión y transparencia para proteger la atención al paciente de la influencia comercial. British Medical Journal, 3 de noviembre de 2021.

Aprobación de medicamentos por la FDA y la ética de la desesperación
29 octubre 2021
Cuando los pacientes tienen un diagnóstico de desesperación que los deja frente a una enfermedad que limita la vida sin buenas opciones de tratamiento, ¿qué papel debe desempeñar su voluntad de probar un medicamento de beneficio no probado en la toma de decisiones regulatorias? En este punto de vista, argumentamos que las voces de los pacientes deben integrarse en el proceso de aprobación de medicamentos, pero sin tal deferencia que la FDA abdique de su responsabilidad de garantizar que los medicamentos sean seguros y efectivos. JAMA Intern Med, 25 de octubre de 2021

Medicamentos sobrantes y caducados en el hogar ¿su almacenaje y desecho representan un problema de salud pública?
20 octubre 2021
Este estudio encontró que los medicamentos más frecuentes fueron metformina, seguido por acetaminofén, espironolactona e ibuprofeno. El estudio muestra la necesidad de desarrollar estrategias multisectoriales para la implementación de políticas sobre el desecho doméstico, las cuales permitirán controlar, y en el mejor de los casos, disminuir el impacto negativo tanto ambiental como en salud pública. Salud Colectiva, 13 de octubre de 2021

Impacto de la Unión Europea en el acceso a medicamentos en países de ingresos bajos y medianos: revisión exploratoria
12 octubre 2021
