Farmacología

Aprobaciones de nuevos medicamentos y productos biológicos en 2019: un análisis sistemático de los datos de la experiencia del paciente en los paquetes de aprobación de medicamentos y el etiquetado de la FDA
04 diciembre 2020
Existen amplias oportunidades para incorporar datos de la experiencia del paciente (DEP) más allá de las evaluaciones de resultados clínicos (ERC) para informar el desarrollo de medicamentos y facilitar la disponibilidad de medicamentos adaptados a las necesidades del paciente. Un mayor nivel de transparencia sobre el papel de DEP en la toma de decisiones regulatorias y un camino claro hacia las declaraciones de etiquetas basadas en DEP podrían incentivar a los patrocinadores y permitir el empoderamiento del paciente en las decisiones de tratamiento. Ther Innov Regul Sci, 23 de noviembre de 2020

La revisión integrada: la FDA moderniza la revisión de nuevas aplicaciones de comercialización de medicamentos
03 diciembre 2020
Este artículo describe los orígenes y la justificación del nuevo proceso de Evaluación Integrada y el documento de Revisión Integrada, resume en qué se diferencian de la revisión tradicional de las aplicaciones de marketing de la FDA y analiza lo que la industria puede esperar de una revisión de medicamentos modernizada. Ther Innov Regul Sci 24 de noviembre de 2020

Aprobación del real decreto por el que se regulan los estudios observacionales con medicamentos
01 diciembre 2020
El objetivo de esta nueva normativa está orientado a simplificar los procedimientos administrativos facilitando la investigación independiente, obtener una evaluación más eficiente de la calidad e idoneidad de cada estudio y actualizar las garantías de transparencia y acceso a la información de estos estudios. AEMPS 27 de noviembre de 2020
Uso apropiado de medicamentos esenciales en los ancianos: una comparación de la lista de medicamentos esenciales de la OMS y los criterios de medicamentos potencialmente inapropiados (PIM)
20 noviembre 2020
Mejorar la información sobre medicamentos para los ancianos en la lista de medicamentos esenciales y establecer una lista de medicamentos esenciales para los ancianos promoverá el uso apropiado de medicamentos en las personas mayores en todo el mundo. Eur J Clin Pharmacol, 10 de noviembre de 2020
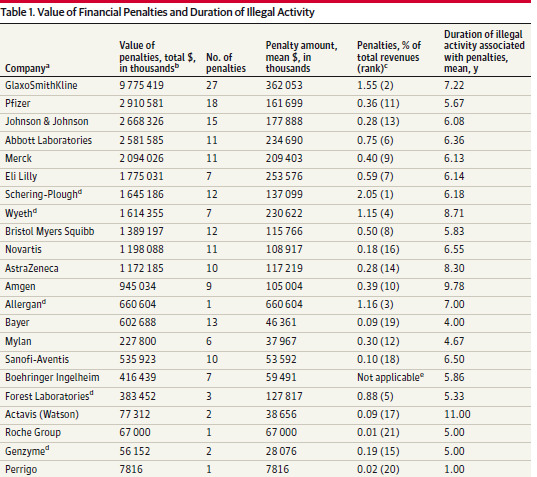
Sanciones financieras impuestas a las grandes empresas farmacéuticas por actividades ilegales
18 noviembre 2020
