Farmacología

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
Una parte sustancial de los fármacos oncológicos aprobados por la FDA por vía acelerada no fueron evaluados por las autoridades regulatorias europeas, o se les negó o retiró la autorización de comercialización. Además, muchas de las aprobaciones en el Reino Unido quedaban sujetas a acuerdos de reducción de precios. JAMA Internal Medicine, 22 de febrero de 2021.
Suero equino hiperimnune para COVID-19: Anmat, SATI y los datos del ensayo.
18 enero 2021
La SATI ha publicado una recomendación de no usar el suero equino, recientemente aprobado por la ANMAT, en pacientes con COVID-19 internados en Terapia Intensiva, con asistencia respiratoria mecánica o con uso previo de plasma de convalecientes. Analizamos los detalles del tratamiento en cuestión para ayudar a comprender el sentido de esta polémica. Qué dice la ANMAT. 18 de enero de 2021.

Financiamiento de la innovación farmacéutica: las lecciones de la pandemia COVID-19
15 enero 2021
Cuando la innovación es imperativa, la dependencia tradicional de los precios y las ganancias de la industria farmacéutica se descarta en favor de las subvenciones y adquisiciones gubernamentales. Esta alternativa permite una atención renovada a las principales necesidades de salud pública y un replanteo de los precios. JAMA, 14 de enero de 2021.
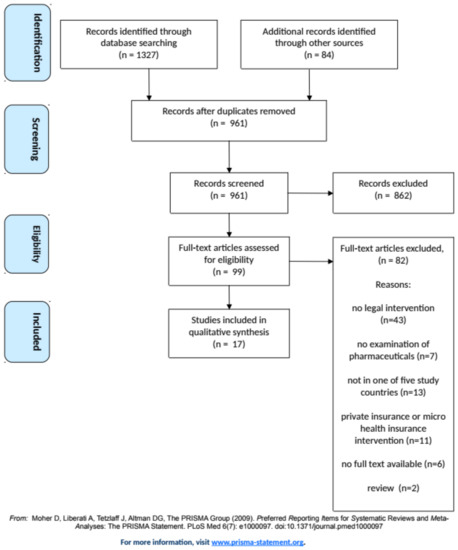
Medicamentos esenciales en la cobertura universal de salud: revisión sistemática exploratoria de intervenciones legales de salud pública y cómo se miden en 5 países de ingresos medios.
23 diciembre 2020
Aunque las intervenciones legales para los productos farmacéuticos en los países de ingresos medianos comúnmente utilizan todos los objetivos de la ley de salud pública, los efectos intencionales y no intencionales de las políticas económicas y la regulación se investigan con mayor frecuencia. Int. J. Environ. Res. Public Health, 18 de diciembre de 2020

Propuesta de retirar del mercado un fármaco aprobado por procedimiento acelerado
10 diciembre 2020
