Farmacología
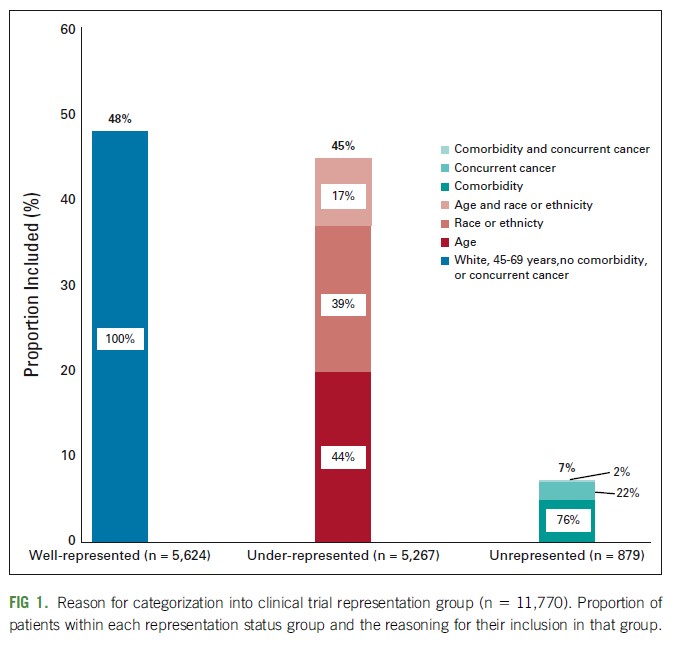
Supervivencia en el mundo real: análisis nacional de pacientes tratadas por cáncer de mama en estadio temprano
28 septiembre 2021
Más de la mitad de los pacientes estaban infrarrepresentados o no estaban representados en los ensayos clínicos debido a la edad, la comorbilidad o la raza. Algunos de estos grupos experimentaron una supervivencia más pobre en comparación con los que estaban bien representados en los ensayos. Los investigadores deben asegurarse de que los participantes del estudio reflejen la población de la enfermedad para respaldar la toma de decisiones basada en evidencia para todas las personas con cáncer. JCO Oncology Practice,24 de septiembre de 2021

Limitaciones de los desenlaces sustitutos en la aprobación acelerada de nuevos medicamentos
17 septiembre 2021
Aunque los criterios de valoración sustitutos se utilizan ampliamente para acelerar la aprobación de nuevos fármacos, la mayoría no son predictores fiables de los resultados que más importan a los pacientes. Los reguladores sólo deben aceptar criterios de valoración sustitutos cuando no sea posible generar datos sobre los resultados clínicos. British Medical Journal, 16 de septiembre de 2021.
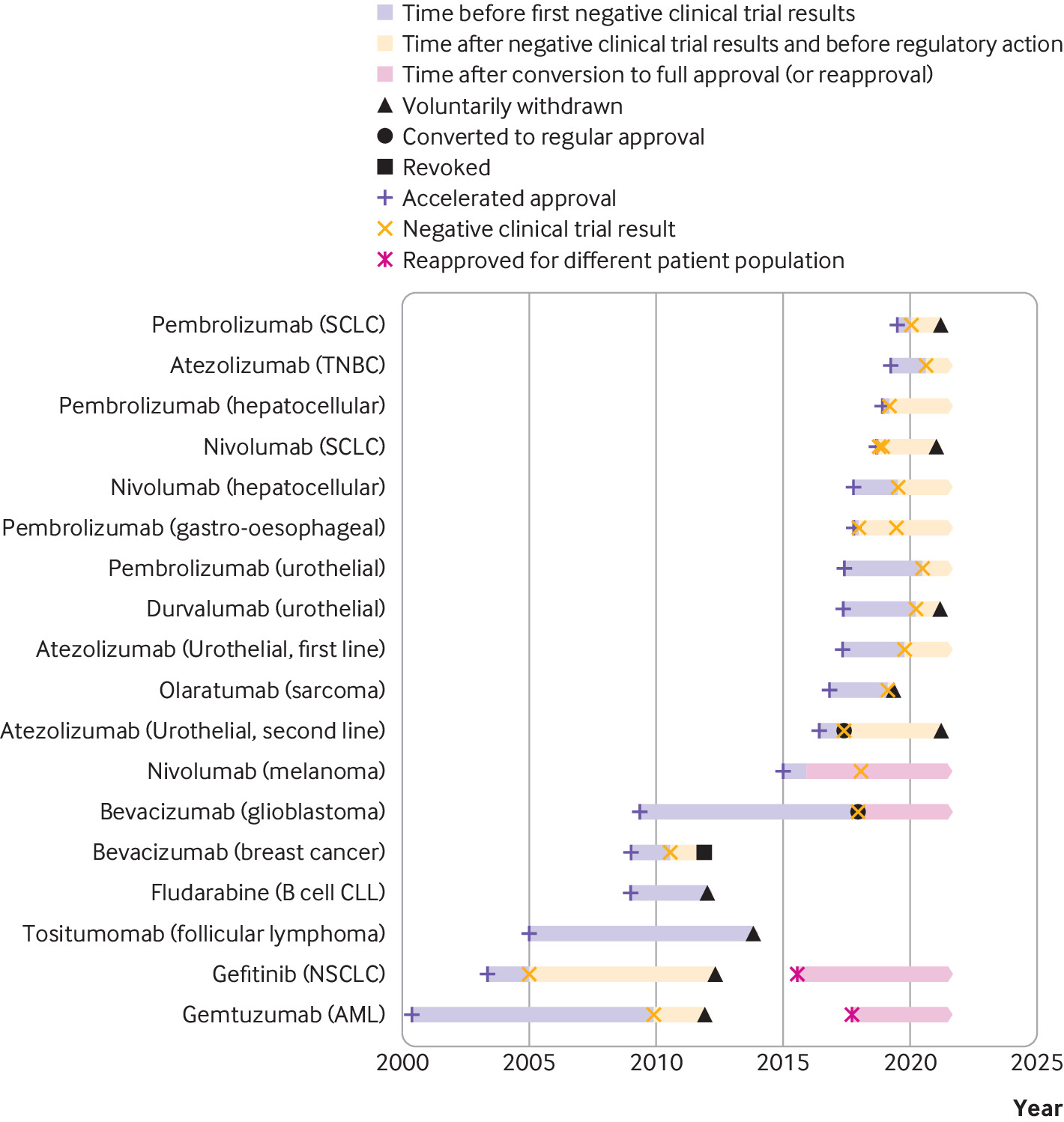
Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
13 septiembre 2021
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021
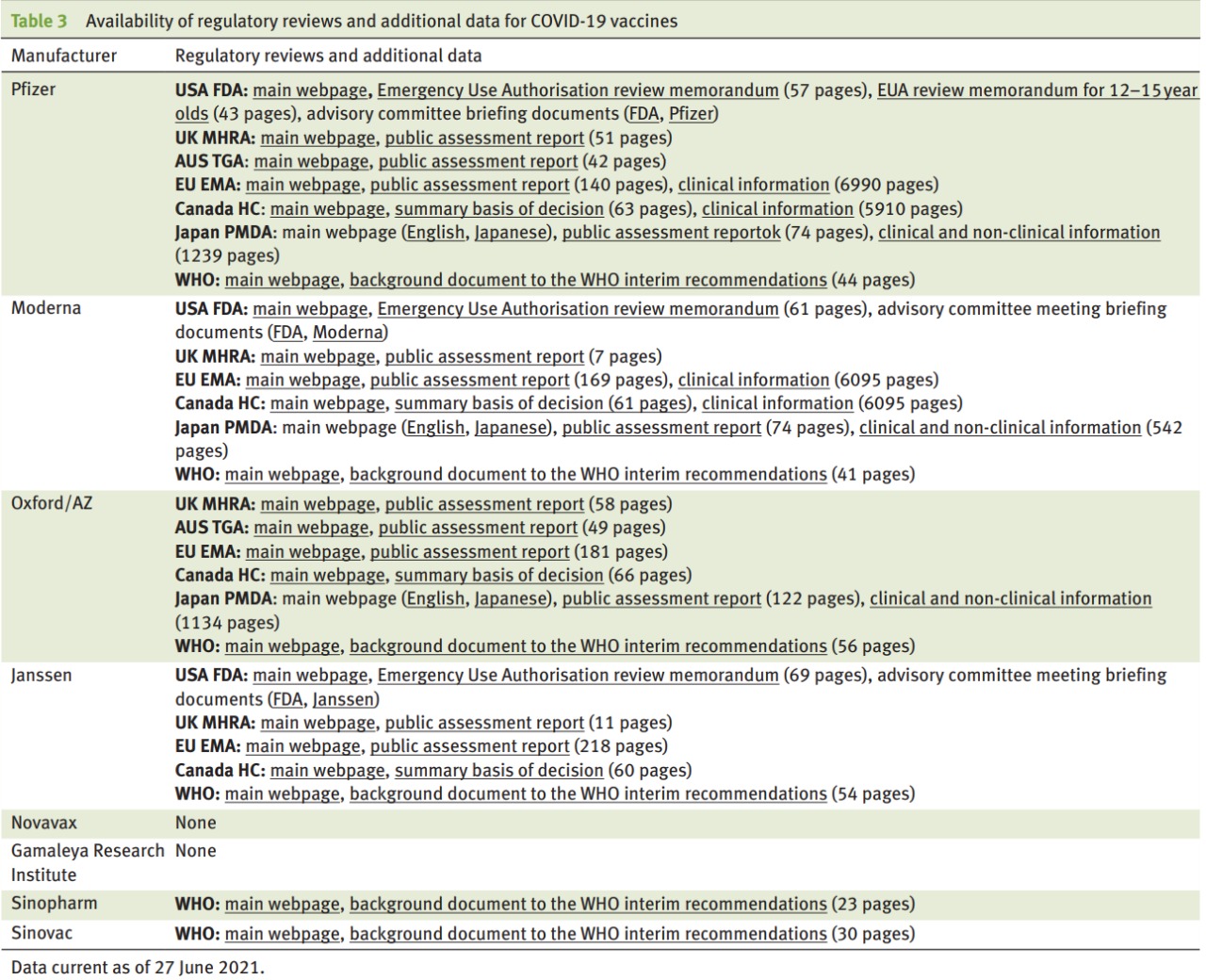
Transparencia de los ensayos de la vacuna COVID-19: decisiones sin datos
23 agosto 2021
La transparencia del ensayo debe comenzar temprano y ser continua. Los protocolos del ensayo deben publicarse una vez finalizados, antes de que se informen los resultados del ensayo, y deben ir acompañados de la publicación de los documentos y datos del ensayo antes de que los médicos y el público tomen decisiones sobre el uso del producto. BMJ Evidence-Based Medicine, 9 de agosto de 2021

Investigación clínica en entornos con recursos limitados. Consenso de un Grupo de Trabajo de CIOMS.
24 junio 2021
