Farmacología
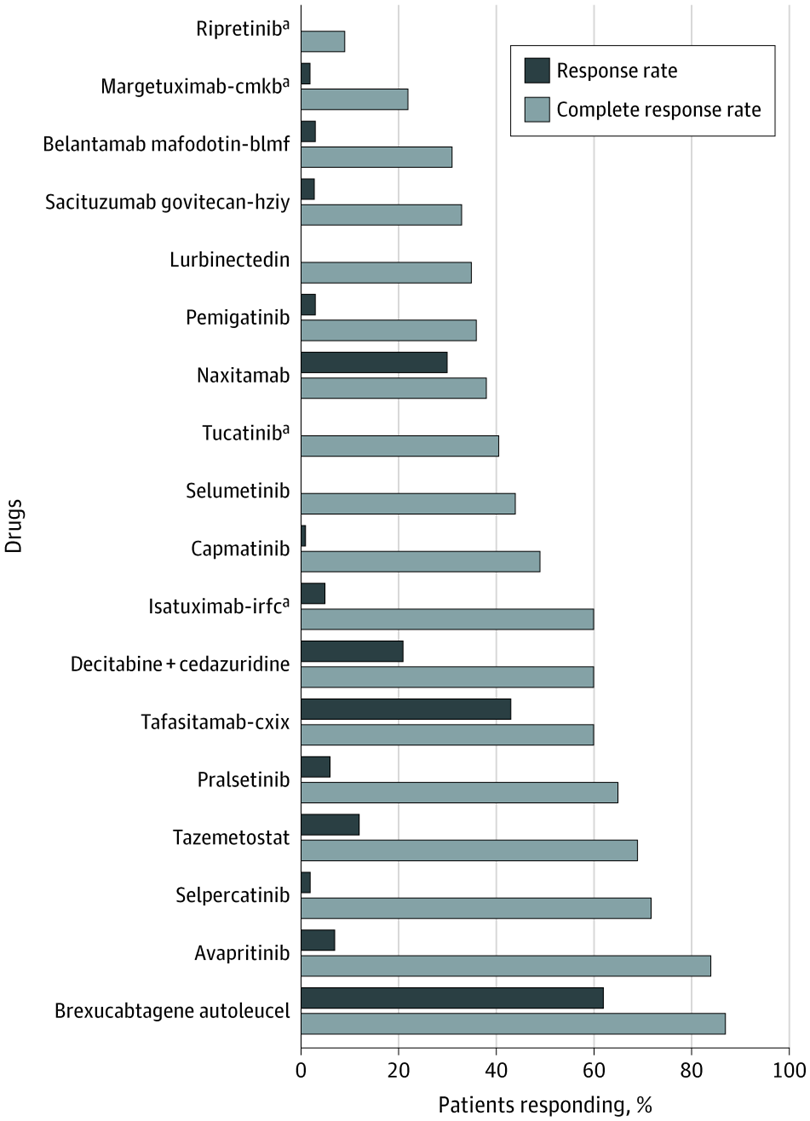
Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
02 junio 2021
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021

Transparencia de datos para construir un sistema de salud más sólido: estudio de caso de bases de datos administrativas argentinas sobre utilización de medicamentos
28 mayo 2021
Aunque se han encontrado fuentes de datos de utilización de medicamentos en Argentina, el acceso a investigadores y formuladores de políticas sigue siendo una barrera importante. Aumentar la transparencia de los datos de salud a través de fuentes disponibles públicamente para analizar la información de salud pública es crucial para construir un sistema de salud más sólido. Salud Colectiva, 27 de mayo de 2021
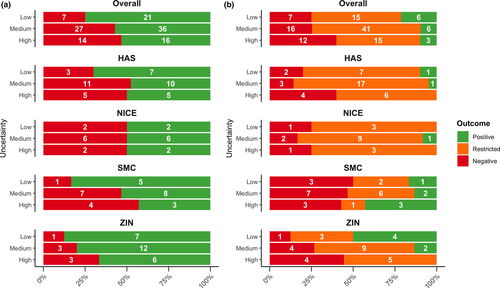
Asociación entre las incertidumbres identificadas por la Agencia Europea de Medicamentos y la toma de decisiones nacional sobre el reembolso por parte de las agencias de ETS
18 mayo 2021
En conclusión, la alta incertidumbre identificada por la EMA se asoció con evaluaciones de efectividad relativa (EER) negativas y recomendaciones de reembolso generales negativas. Para reducir la incertidumbre y, en última instancia, facilitar el acceso eficiente de los pacientes, los reguladores, las agencias de ETS y otras partes interesadas deben analizar cómo se deben sopesar y abordar las incertidumbres en las primeras etapas del ciclo de vida del fármaco de los tratamientos innovadores. Clin Transl Sci 30 de marzo de 2021
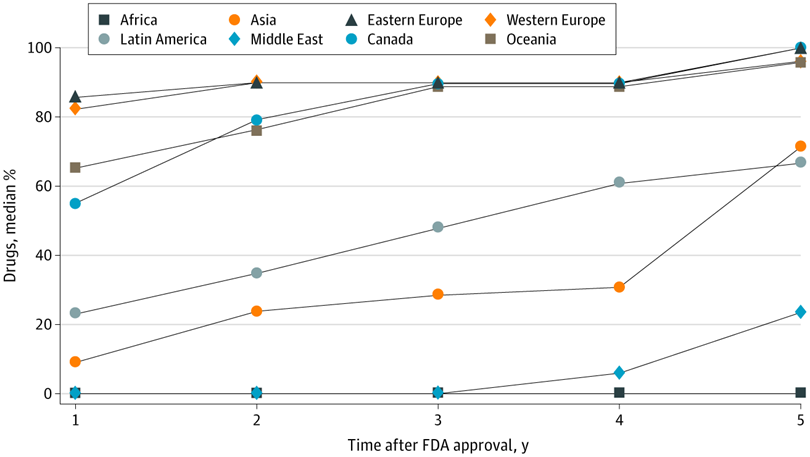
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
Estos hallazgos sugieren que existen brechas sustanciales entre dónde se prueban los medicamentos aprobados por la FDA y dónde finalmente están disponibles para los pacientes, lo que genera inquietudes sobre la distribución equitativa de los beneficios de la investigación a nivel de la población. JAMA Netw Open. 5 de mayo de 2021
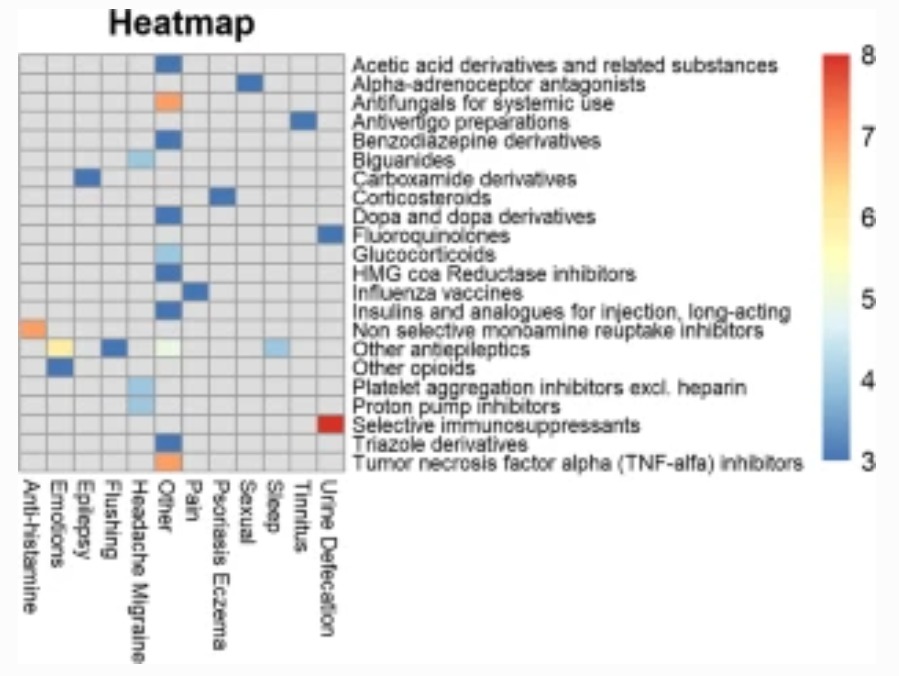
Efectos beneficiosos inesperados de los fármacos: análisis de casos en el sistema holandés de notificación espontánea
14 mayo 2021
